金泽大学的研究团队在《科学进展》期刊上发布了一项关于高速原子力显微镜实验的研究,揭示了一种酶的结构及其化学变化,这种酶在调节神经连接强度方面被认为至关重要。
突触连接神经元,使得信号能够在神经网络中传递。这些连接的强度各有不同,通常会根据接收到的信号及其传递方式而增强或减弱。这种突触的“可塑性”是学习和记忆的基础,而Ca2+/钙调素依赖性蛋白激酶II (CaMKII)在其中扮演了关键角色。
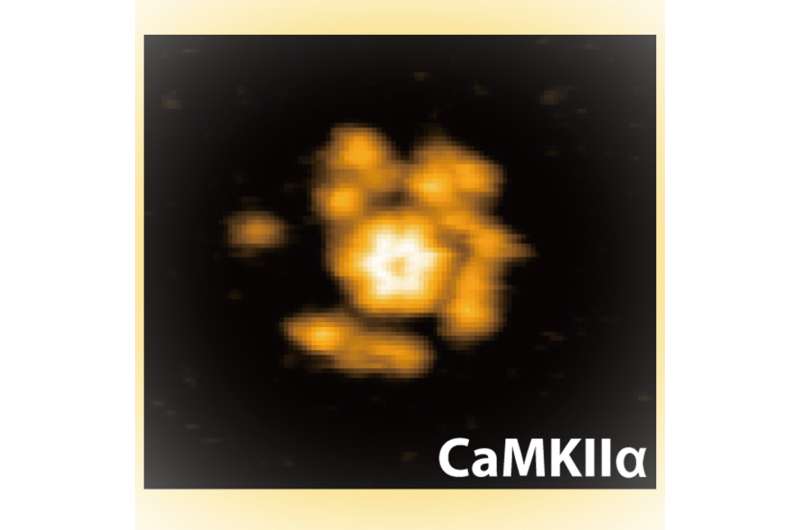
尽管之前的研究为CaMKII蛋白在这些功能中的活性机制提供了一些线索,但尚未有人观察到这些蛋白的具体作用。现在,来自高级研究生大学和国家生理科学研究所的Hideji Murakoshi与金泽大学的Mikihiro Shibata及其团队首次利用高速原子力显微镜(HS-AFM)观察到这些蛋白质的结构动态,涵盖了不同状态和三种不同物种。
CaMKII在多种物种中普遍存在,从像老鼠这样的哺乳动物到更古老的非哺乳动物,如蛔虫和水螅。特别是,该蛋白质的一些结构特征得到了良好的保留,包括激酶结构域、调控抑制激酶结构域活性的片段和枢纽结构域。此外,该蛋白还具有结合位点、磷酸化位点和连接区域——不过,连接区域表现出更大的变异性,表明其功能和激活机制可能更适应不同物种。
先前的研究表明,当Ca2+/钙调蛋白结合到调控片段时,调控片段对激酶结构域的抑制作用会被解除。激活的激酶结构域会相互磷酸化,即使在Ca2+/钙调蛋白解离后,活性依然存在,正如研究人员在报告中所描述的,这被视为“分子记忆的一种形式”。
Murakoshi、Shibata及其同事利用原子力显微镜研究蛋白质,原子力显微镜通过纳米级尖端感知样品的拓扑结构,类似于黑胶唱片的针头读取音轨,光栅扫描图像平面以构建样品结构的图像。使用HS-AFM,这些图像的采集速度足够快,可以记录下这些结构变化的动态过程。
研究人员对蛋白质的大小和运动进行了多种测量——包括旋转回转——以及激酶结构域的寡聚化(即在有限的聚合水平上将分子连接成链)和磷酸化(磷酸基团的添加),这可以激活激酶等酶。
他们发现激酶结构域相对可移动,尽管这种移动性在Ca2+/钙调蛋白结合后有所降低。研究人员解释说,这种结合使蛋白质稳定在一种称为α螺旋的特殊螺旋结构中。他们还观察到,这种结合使蛋白质从轮毂组装延伸了3纳米,研究人员认为这可能是将调节片段与激酶结构域的活性位点分开的原因。随后,随着磷酸化的发生,移动性再次增加,研究人员将其归因于蛋白质失去了一些螺旋结构的有序性。
在研究的三种物种中——大鼠、蛔虫和水螅——Murakoshi、Shibata及其同事发现,激酶结构域仅在大鼠中表现出寡聚化。此外,在大鼠体内,这种蛋白质对磷酸酶的反应更为灵活,磷酸酶能够从蛋白质中去除磷酸基团。
“总之,”他们在报告中指出,“我们的发现为深入理解CaMKIIα激活的分子机制奠定了基础。”

